Cet article a été mis à jour pour la dernière fois le juillet 5, 2023
Thérapeutique ARNm – Doit-elle être classée comme thérapie génique ou vaccins?

Thérapeutique ARNm – Doit-elle être classée comme thérapie génique ou vaccins?
Un article récent intitulé «ARNm : vaccin ou thérapie génique ? Les questions réglementaires de sécurité» paru dans l’International Journal of Molecular Sciences le 22 juin 2023 :
… examine la question de savoir si les vaccins à ARNm COVID-19 doivent ou non être classés comme thérapie génique et s’ils ont été suffisamment examinés par les régulateurs gouvernementaux, l’une des questions clés qui a été renvoyée à «l’arrière-pays de la théorie du complot» par le courant dominant médias, vérificateurs de faits et responsables gouvernementaux de la santé.
Commençons par définir un produit de thérapie génique (GTP) :
1.) Selon la Food and Drug Administration des États-Unis, la thérapie génique est une intervention médicale basée sur la modification du matériel génétique des cellules vivantes. Les cellules peuvent être modifiées in vivo par une thérapie génique administrée directement au sujet.
2.) Selon l’Agence européenne des médicaments (EMA) (2009), un GTP :
a) contient une substance active qui contient ou consiste en un acide nucléique recombinant utilisé ou administré à l’être humain en vue de réguler, réparer, remplacer, ajouter ou supprimer une séquence génétique; et
(b) dans ses effets thérapeutiques, prophylactiques ou diagnostiques, se rapporte directement à la séquence d’acide nucléique recombinant qu’elle contient, ou au produit de l’expression génétique de cette séquence.
Voyons maintenant la définition d’un vaccin :
1.) Selon le CDC des États-Unis, un vaccin est « une préparation utilisée pour stimuler la réponse immunitaire de l’organisme contre les maladies ». Cette définition a été modifiée en septembre 2021 et se lisait auparavant « un produit qui stimule le système immunitaire d’une personne pour produire une immunité contre une maladie spécifique, protégeant la personne de cette maladie ».
2.) Selon la réglementation européenne, les vaccins sont des produits capables de produire une immunité active et contiennent des antigènes capables d’induire une immunité active contre un agent infectieux.
Gardez à l’esprit que selon l’EMA, la substance active des vaccins à ARNm COVID-19 est l’ARNm, et non un antigène, ce qui signifie que les produits à ARNm ne doivent pas être considérés comme des vaccins.
L’article d’Hélène Banoun, une chercheuse française indépendante avec un long dossier de publication que vous pouvez voir ici s’ouvre sur ceci :
« Les vaccins COVID-19 ont été développés et approuvés rapidement en réponse à l’urgence créée par la pandémie. Aucune réglementation spécifique n’existait au moment de leur commercialisation. Les agences de régulation les ont donc adaptés en urgence. Maintenant que l’urgence pandémique est passée, il est temps d’examiner les problèmes de sécurité associés à cette approbation rapide….
Certains des tests qu’ils ont subis en tant que vaccins ont donné des résultats non conformes en termes de pureté, de qualité et d’homogénéité des lots. La biodistribution large et persistante des ARNm et de leurs produits protéiques, incomplètement étudiée en raison de leur classification en tant que vaccins, soulève des problèmes de sécurité. Des études post-commercialisation ont montré que l’ARNm passe dans le lait maternel et pourrait avoir des effets indésirables sur les bébés allaités. L’expression à long terme, l’intégration dans le génome, la transmission à la lignée germinale, le passage dans le sperme, la toxicité embryo/fœtale et périnatale, la génotoxicité et la tumorigénicité doivent être étudiées à la lumière des événements indésirables rapportés dans les bases de données de pharmacovigilance. La transmission horizontale potentielle (c.-à-d. la perte) devrait également avoir été évaluée. Une vaccinovigilance approfondie doit être effectuée. Nous nous attendrions à ce que ces contrôles soient nécessaires pour les futurs vaccins à ARNm développés en dehors du contexte d’une pandémie.
Comme nous devrions tous le savoir, les vaccins à ARNm COVID-19 ont été les premiers vaccins à ARNm commercialisés auprès du public et, en tant que nouvelle classe de vaccins, devraient faire l’objet d’un examen plus approfondi étant donné qu’ils sont basés sur de nouvelles technologies. Cela dit, les vaccins à ARNm contre une maladie infectieuse ont été exclus de la réglementation sur les produits de thérapie génique (GTP) par des réglementations aux États-Unis et dans l’Union européenne, en grande partie parce que les thérapeutiques à ARNm ne sont pas mentionnées dans les directives actuelles.
Dans cette étude, l’auteur a comparé les contrôles requis par la réglementation GTP avec ceux qui ont été effectivement appliqués aux vaccins à ARNm COVID-19. et a constaté que, parce que les vaccins à ARNm COVID-19 n’étaient pas classés comme thérapie génique, les tests normalement requis pour les produits de thérapie génique ne suivaient pas, notamment les suivants (entre autres) :
1.) Expression à long terme
2.) Intégration dans le génome
3.) Transmission à la lignée germinale (c’est-à-dire sperme, gonades, gamètes)
4.) Passage en toxicité embryo/fœtale et périnatale,
5.) Génotoxicité
6.) Tumorigénicité
7.) Délestage des études/transmission à un tiers
8.) Excrétion dans l’environnement
Les vaccins à ARNm COVID-19 ont été précipités dans la production et la distribution en réponse à la perception d’une urgence sanitaire mondiale en quelques mois avec des examens continus où les données sont soumises et examinées par les organismes de santé gouvernementaux au fur et à mesure qu’elles deviennent disponibles, avant le plein ensemble de données est disponible pour les régulateurs et le grand public. Les phases finales des essais n’ont été et n’ont toujours pas été achevées que des mois ou des années après que les produits d’ARNm aient été injectés dans les bras de milliards d’humains.
Selon la FDA, un suivi à long terme des événements indésirables associés aux GTP doit être effectué pendant au moins cinq ans pour les nouvelles conditions cliniques, y compris les nouvelles tumeurs malignes, la nouvelle incidence ou l’exacerbation d’un trouble neurologique préexistant, les nouvelles incidence ou exacerbation d’un trouble rhumatologique ou d’un autre trouble auto-immun antérieur, nouvelle incidence d’un trouble hématologique et nouvelle incidence d’infection (potentiellement liée au produit).
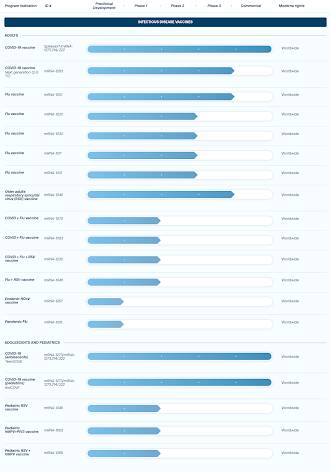
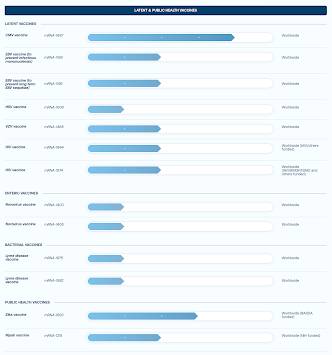
L’application de directives strictes aux thérapies à base d’ARNm est d’une importance cruciale étant donné que Big Pharma, en particulier Moderna, prévoit de commercialiser des «vaccins» contre la grippe à ARNm ainsi que des «vaccins» anticancéreux, comme indiqué sur ce graphique ce qui montre que plusieurs de ces vaccins sont déjà en essais de Phase 2 :
Ce qui est encore plus préoccupant, c’est que Big Pharma prévoit de remplacer les vaccins traditionnels par des vaccins à ARNm.
Terminons par quelques citations supplémentaires et la conclusion de l’article d’Hélène Banoun avec mes caractères gras :
« La surveillance à long terme de la sécurité des GTP est requise sur plusieurs années alors que, pour les vaccins, elle ne s’effectue généralement que sur quelques semaines. Cela ne devrait pas être acceptable, compte tenu de la persistance du produit médicamenteux et de la protéine exprimée. Les résultats connus des thérapies anticancéreuses et des vaccins à ARNm pourraient faire anticiper des problèmes de sécurité et d’efficacité. Dans le cas des ARNm anticancéreux, la grande majorité des essais cliniques ouverts ont été réalisés sur de très petits nombres de patients, avec des résultats soit non publiés, soit négatifs. Des études randomisées ont également montré des résultats négatifs, rapportant des événements indésirables plus fréquents dans le groupe de traitement…
D’un point de vue de santé publique, et sachant que les ARNm anti-COVID-19 considérés comme des vaccins n’ont pas subi tous les contrôles stricts requis pour les GTP, on pourrait objecter qu’un produit destiné à la majorité de la population mondiale saine fasse l’objet de réglementation plus stricte qu’une GTP destinée à quelques rares personnes atteintes d’une maladie rare ou d’un cancer…
Le rôle des organismes de réglementation est d’assurer la sécurité et l’efficacité des médicaments. L’urgence pandémique COVID-19 a accéléré le calendrier de production et d’utilisation clinique des vaccins COVID-19 ; il est donc possible que certains aspects de la sécurité n’aient pas été pleinement pris en compte. Il est donc important de prendre en compte ces aspects à l’avenir, afin de ne pas ébranler la confiance du public dans les vaccins en général….
À l’avenir, il conviendra de se demander si tous les produits à base d’ARNm doivent être soumis aux mêmes réglementations et contrôles, qu’ils soient ou non considérés comme des vaccins. Il n’est pas justifiable de soumettre les ARNm thérapeutiques à des contrôles stricts lorsqu’ils sont destinés à des patients représentant une faible proportion de la population humaine, et d’exclure de ces contrôles les vaccins à ARNm destinés à la majorité de la population humaine saine.
ARNm Thérapeutique

Soyez le premier à commenter